Struktura europio, właściwości, uzyskiwanie, użycia

- 3891
- 1192
- Eliasz Dubiel
On Europio Jest to element chemiczny należący do ziem rzadkich, reprezentowany przez symbol chemiczny UE, a którego nazwa jest, najwyraźniej, do kontynentu europejskiego. Jest to najbardziej reaktywna dla metali ziem rzadkich, porównując lit, wapń i bar barowy, dlatego jego dyfuzja mineralogiczna jest bardzo rozproszona.
Jest to jeden z najcięższych i najdroższych metali, ze względu na wszystkie procedury, które należy wykonać w celu wydobycia wolnych od zanieczyszczeń. Fizycznie pokazuje szarawy złoty blask, spowodowany jego szybkim utlenianiem, ledwo narażony na powietrze. Dlatego rzadko jest możliwe przechowywanie go z autentycznym srebrnym kolorem.
 Utlenione europejskie. Źródło: Obrazy Hi-Res Elementów Chemicznych/CC (https: // CreativeCommons.Org/licencje/według/3.0)
Utlenione europejskie. Źródło: Obrazy Hi-Res Elementów Chemicznych/CC (https: // CreativeCommons.Org/licencje/według/3.0) Europejum jest tak reaktywne, że musi być przechowywane w ampułkach lub zamkniętych pojemnikach w obojętnej atmosferze argonowej. Nawet zanurzony w oleju mineralnym jest utleniany przez mały rozpuszczony tlen.
Znakomita cecha europejskiego jest jego luminescencja, szczególnie obserwowana w jego związkach z liczbą utleniania +3, taką jak USA2ALBO3, który jest czerwonym fosforem stosowanym w nieskończoności urządzeń elektronicznych, a także na biletach euro, aby zapobiec jego fałszerstwom.
[TOC]
Odkrycie Europio
Odkrycie europejskiego powstało w części, przez cały dziewiętnasty wiek oraz w różnych krajach (Szwecja, Niemcy i Szwajcaria) kontynentu europejskiego. Jony europejskie były trudne do zidentyfikowania, ponieważ ich widma absorpcyjne zmieszane z widmami innych metali ziem rzadkich, takich jak wzgórze, gadolinium i lantem, a także Samarium.
Dlatego identyfikacja i izolacja wszystkich tych metali przeciągnęła europejię jako zanieczyszczenie bez charakteryzowania. Na przykład izolacja czystej próbki Cerio, w 1839 r. Przez Carla Gustava Mosandera, miała jako produkt rozpoznawanie innych nowych elementów: Lantano i Didimio.
Podczas studiowania Didimio i wniosku, że naprawdę składało się ono z mieszanki innych pierwiastków (prozą i neodym), pojawił się Samario, znaleziony w 1879 roku przez Paula èmile Lecoq.
Może ci służyć: aluminiowy wodorek (ALH3): struktura, właściwości, użyciaPóźniej, w 1886 r., Szwajcarski chemik Jean Charles Galissard oczyszczył próbki Samarium, znajdując Gadolinio. Lecoq dla 1892 roku badał już widma Gadolinio i widm innego nowego elementu.
Piętnaście lat później, w 1901 roku, francuski chemik Eugène Anatole Demarcay ostatecznie wyizolował ten nowy element i ochrzcił go jako Europejum, na cześć Europy.
Struktura chemiczna europejskiego
Atomy Europu pozostają zjednoczeni dzięki obligacji metalicznej, uczestnicząc w jej elektrony ich orbitali 4F i 6S. W wyniku jego charakterystyki elektronicznej, radiotelefów atomowych i trybu opakowania Europejium przyjęto sześcienną strukturę krystaliczną wyśrodkowaną na ciele (BCC), co jest jednym z najmniej gęstymi gęstymi.
Nie ma źródeł bibliograficznych, które wspominają o innym polimorfie dla Europio, oprócz wspomnianej fazy BCC, w innych zakresach temperatury; Ale pod różnymi presją.
Na przykład europejum poddane ciśnieniu zbliżonym do 18 GPA przyjmuje zwartą sześciokątną strukturę, a następnie w końcu przekształca się w fazę monokliniczną na wyższe ciśnienie 31.5 GPA.
Elektroniczna Konfiguracja
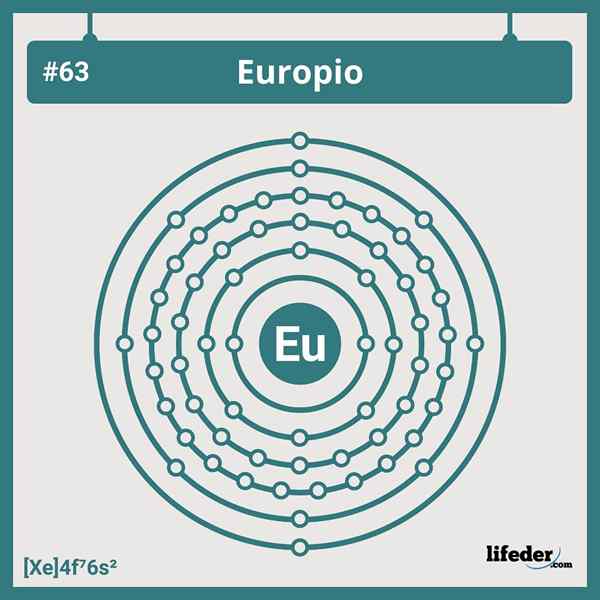 Elektroniczna konfiguracja europu
Elektroniczna konfiguracja europu Skrócona konfiguracja elektroniczna Europuum wynosi:
[Xe] 6s24f7
Będąc w pozycji lub grupie 7 serii Lantanide, ma siedem elektronów zajmujących orbitale 4F; I dlatego nie odpowiada żadnemu z odchyleń, które znajdujemy w konfiguracjach elektronicznych dla elementów tabeli okresowej.
Nieruchomości Europio
Wygląd fizyczny
Srebrny biały metal, miękka twardość podobna do ołowiu i która staje się złoty, gdy jest wystawiony na powietrze, pokrywając warstwę tlenku i węglanu.
Liczba atomowa
63
Masa cząsteczkowa
151.96 g/mol
Temperatura topnienia
826 ° C
Punkt wrzenia
1529 ° C
Gęstość
Solid: 5.264 g/cm3
W punkcie topnienia: 5.13 g/cm3
Stany utleniania
Główne stany utleniania europejskiego wynoszą +2 (UE2+) i +3 (UE3+), Będąc +1 (UE+) Najmniej powszechne z trzech.
Może ci służyć: polarne kowalencyjne link: Charakterystyka i przykładyEnergie jonizacyjne
-Po pierwsze: 547.1 kJ/mol (UE+ gazowy)
-Po drugie: 1085 kJ/mol (UE2+ gazowy)
-Po trzecie: 2404 kJ/mol (UE3+ gazowy)
Elektronialiczność
1.2 na skali Pauling.
Zakon magnetyczny
Paramagnetyczny
Reaktywność
Reaktywność europejskiej jest porównywalna z reakcją litu, a zatem jest to najbardziej reaktywny metal o ziemskich ziemiach. Na przykład reaguj szybko z wodą, tworząc odpowiednią wodorotlenek, UE (OH)3, Żółty, który w przeciwieństwie do wodorotlenków alkalicznych jest nierozpuszczalny w wodzie:
2 UE + 6 H2O → 2 UE (OH)3 + 3 godz2
Ponadto, gdy płonie w lżejszej utlenionej do USA2ALBO3 I odrzucił czerwony płomień, przypominający płomień litu:
4 UE + 3 O2 → 2 UE2ALBO3
Europejium jest w stanie utworzyć wiele związków ze stanem utleniania +2, ponieważ ma orbitale F w połowie pełny (4f7), co nadaje jej atomowi niezwykłą stabilność elektroniczną.
Kation UE2+ przedstawia zachowanie chemiczne podobne do zachowania BA2+, Ale w przeciwieństwie do tych ostatnich, działa jako umiarkowanie silny środek redukujący, utleniający USA3+.
Uzyskanie
Surowiec
Europejum jest obecne w minerałach ziem rzadkich, takich jak Bastnasita i Monazite. Ponieważ jednak zachowuje pewne podobieństwo do metali alkalicznych i alkalicznych w odniesieniu do ich reaktywności, ich jony są bardzo rozproszone w korze Ziemi obok minerałów wapnia lub innych metali, więc nie ma samego minerału, że jest bogaty w europie. Dlatego uzyskanie jest bardzo drogie.
Procesy
Jony UE3+ Są częścią wielu fosforanów rdzy i ziem rzadkich. Dlatego pierwszym krokiem jest oddzielenie ich od innych obecnych metali. Aby to zrobić, minerały są przetwarzane, zwłaszcza bastnasite; Są dotknięte, rozpuszczają się w silnych kwasach lub zasadach, a frakcjonowane opady deszczu są poddawane za pomocą różnych odczynników. Podobnie, chromatografia wymiany jonów służy do oddzielenia USA3+.
W miarę przetwarzania minerału uzyskuje się koncentrat jonów UE3+, które można zmniejszyć przy użyciu metalicznego cynku lub jego amalgamatu, aby zostały zredukowane do USA2+. Wtedy USA2+ Coprecipita na węglan lub siarczanach baru.
Może ci służyć: katalityczne uwodornienieTen osad jest trzymany i ulega separacji w celu uzyskania tlenku UE2ALBO3, który jest zmniejszony z Lantano w tyglu Tantalio, aby w końcu destylują i kondensuje metaliczne europie.
Inną metodą uzyskania europejskiego jest wykonanie elektrolizy mieszaniny EUCL3 i NaCl lub CACL2 ciekły. Zatem gaz chloru występuje w anodzie, podczas gdy w katodzie powstaje metaliczny europio.
Używa/aplikacje
 Czerwona luminescencja widoczna w tym bilecie euro, pod lampą UV, jest spowodowana kompleksem Europii. Źródło: Repro przez H. Grobe/cc przez (https: // creativeCommons.Org/licencje/według/3.0)
Czerwona luminescencja widoczna w tym bilecie euro, pod lampą UV, jest spowodowana kompleksem Europii. Źródło: Repro przez H. Grobe/cc przez (https: // creativeCommons.Org/licencje/według/3.0) Europejum w swojej metalicznej formie brakuje rutynowych zastosowań. Jednak jego związki to inna historia, zwłaszcza jej tlenek UE2ALBO3, którego fosforescencja została wykonana przez niezbędny składnik ekranów na urządzeniach, monitorach i telewizorach. Jest tak, ponieważ jest to czerwony fosfor, emitujący charakterystyczne czerwone światło.
Czerwona fosforescencja Europio (III) jest również wykorzystywana w celu zapobiegania sfałszowaniu biletów euro, oświetlającym światłem UV w celu potwierdzenia jego legitymacji.
Z drugiej strony, po zmieszaniu ze związkami euro (II), które są niebieskawe dopasowy, uzyskuje się białe światło, bardzo nawracające w szklance lamp fluorescencyjnych.
Europejium jest dodawane w małych ilościach do glinianu strontu w celu przygotowania fosforu o różnych kolorach, które wyróżniają się długoterminową fosforescencją.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- National Center for Biotechnology Information. (2020). Europ. Podsumowanie elementu Pubchem. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2020). Europ. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (2020). Europ. Odzyskane z: Britannica.com
- R. J. Mąż i in. (27 sierpnia 2012 r.). Europium-IV: Niezgodnie. Odzyskane z: czasopisma.APS.org
- David. Skowron. (26 listopada 2017 r.). Do czego służy europejum? - Wspólne i historyczne zastosowania. Badanie. Odzyskane z: Study.com
- Dr. Doug Stewart. (2020). Fakty elementów europejskich. Odzyskane z: Chemicool.com

