Etano
- 1527
- 65
- Marianna Czarnecki
 Struktura Estano
Struktura Estano Co to jest etan?
On Etano Jest to prosty wzór C węglowodorów2H6 Z bezbarwną i toaletą, która ma wysoce cenne i zróżnicowane zastosowanie w syntezie etylenu. Ponadto jest to jeden z gazów lądowych, który został również wykryty na innych planetach i gwiazdorskich ciałach wokół układu słonecznego. Został odkryty przez naukowca Michaela Faradaya w 1834 roku.
Spośród dużej liczby związków organicznych utworzonych przez atomy węgla i wodoru (znane jako węglowodory), istnieją takie, które są w stanie gazowym w temperaturach i ciśnieniach środowiskowych, które są bardzo stosowane w wielu branżach.
Zwykle pochodzą one z gazowej mieszaniny zwanej „gazem ziemnym”, iloczykiem o wysokiej wartości dla ludzkości i tworzą między innymi metan, etan, propan i butan; kwalifikacja według ilości atomów węgla w jego łańcuchu.
Struktura chemiczna etanu
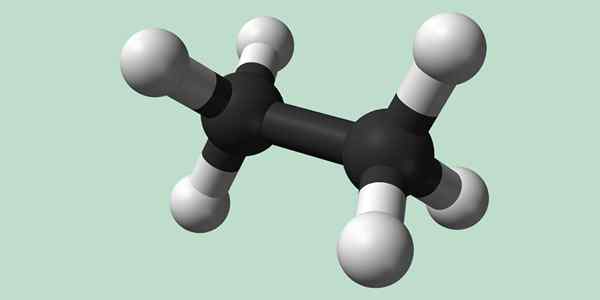
Estano jest wzorem cząsteczki C2H6, zwykle postrzegane jako związek dwóch grup metylowych (-ch3) W celu utworzenia węglowodorów prostego wiązania węglowego węglowego. Jest to również najprostszy związek organiczny po metanie, reprezentujący siebie:
H3C-ch3
Atomy węgla w tej cząsteczce mają hybrydyzację typu SP3, Tak więc wiązania molekularne mają swobodny obrót.
Istnieje również wewnętrzne zjawisko Etano, które jest oparte na obrotu jego struktury molekularnej i minimalnej energii wymaganej do wytworzenia obrotu łącza o 360 stopni, którą naukowcy nazywali „Etano Barrera”.
Z tego powodu Ethan.
 Struktura chemiczna etanu. Źródło: Wikimedia Commons
Struktura chemiczna etanu. Źródło: Wikimedia Commons Synteza etanu
Estano można łatwo zsyntetyzować z elektrolizy Kolbe, reakcji organicznej, w której występują dwa etapy: dekarboksylacja elektrochemiczna (usunięcie grupy karboksylowej i wyzwolenie dwutlenku węgla) dwóch kwasów karboksylowych oraz kombinacja produktów pośrednich związanych z produktami w celu utworzenia wiązania powiązanego.
Podobnie elektroliza kwasu octowego powoduje tworzenie etanu i dwutlenku węgla, a reakcja ta jest stosowana do syntezy pierwszej.
Utlenianie bezwodnika octowego przez działanie nadtlenków, koncepcja podobna do elektrolizy Kolbe, powoduje również powstawanie etanu.
Może ci służyć: wkład chemii w ludzkośćW ten sam sposób można go skutecznie oddzielić od gazu ziemnego i metanu przez proces upłynnienia, przy użyciu systemów kriogenicznych do przechwytywania tego gazu i oddzielenia go od mieszanin z innymi gazami.
Proces ekspansji turbo jest ulubionym dla tej roli: mieszanina gazu jest wytwarzana przez turbinę, generując jej rozszerzenie, dopóki jej temperatura spadnie poniżej -100 ° C.
Już w tym momencie elementy mieszaniny można odróżnić, więc ciekł etan od gazowego metanu i inne gatunki zaangażowane w stosowanie destylacji zostaną oddzielone.
Właściwości Estano
Estano jest prezentowany w naturze jako toaleta i bezbarwny gaz do standardowych ciśnień i temperatur (1 atm i 25 ° C). Ma temperaturę wrzenia -88,5 ° C i punkt fuzji -182,8 ° C. Ponadto narażenie na silne kwasy lub zasady nie ma wpływu.
Rozpuszczalność etanu
Cząsteczki etano to konfiguracja symetryczna i mają słabe siły przyciągania, które utrzymują je razem, zwane siłami dyspersji.
Kiedy etan próbuje rozpuścić w wodzie, siły przyciągania utworzone między gazem a cieczą są bardzo słabe, tak że etan prawie nie przyłączył się z cząsteczkami wody.
Z tego powodu rozpuszczalność etanu jest znacznie niska, nieznacznie rosną.
Krystalizacja etanu
Estano można zestalić, tworząc niestabilne kryształy etanu o sześciennej strukturze krystalicznej.
Wraz ze spadkiem temperatury powyżej -183,2 ° C struktura ta staje się monokliniczna, zwiększając stabilność jej cząsteczki.
Spalanie etanu
Ten węglowodor, nawet jeśli nie jest powszechnie stosowany jako paliwo, może być stosowany w procesach spalania do generowania dwutlenku węgla, wody i ciepła, który jest reprezentowany w następujący sposób:
2 c2H6 + 7th2 → 4co2 + 6h2O + 3120 kJ
Istnieje również możliwość spalania tej cząsteczki bez nadmiaru tlenu, który jest znany jako „niepełne spalanie”, co powoduje tworzenie amorficznego węgla i tlenku węgla w niechcianej reakcji, zgodnie z ilością zastosowanego tlenu:
Może ci służyć: sterole: struktura, funkcje i przykłady2 c2H6 + 32 → 4c + 6h2Lub + ciepło
2 c2H6 + 42 → 2c + 2co + 6h2Lub + ciepło
2 c2H6 + 52 → 4co + 6h2Lub + ciepło
W tym obszarze spalanie występuje w wyniku serii reakcji wolnych rodników, które są ponumerowane w setkach różnych reakcji. Na przykład w niekompletnych reakcjach spalania można tworzyć związki, takie jak formaldehyd, aldehyd oceny, metan, metanol i etanol.
Będzie to zależeć od warunków, w których występuje reakcja i reakcje wolnych rodników. Etylen może również tworzyć się w wysokich temperaturach (600-900 ° C), co jest wysoce pożądanym produktem branży.
Estano w atmosferze i ciałach niebieskich
Estano jest obecny w atmosferze planety Ziemi w śladach i podejrzewa się, że człowiekowi udało się podwoić tę koncentrację, odkąd zaczął ćwiczyć działalność przemysłową.
Naukowcy uważają, że duża część obecnej obecności ETA w atmosferze wynika z spalania paliw kopalnych, chociaż światowa emisja etanu spadła prawie w połowie drogi od czasu technologii produkcji gazu Lutita (źródło gazu ziemnego).
Gatunek ten występuje również naturalnie przez wpływ promieni słonecznych na metan atmosferyczny, który rekombina i tworzy cząsteczkę etanową.
Na powierzchni Tytana znajduje się etan, jeden z księżyców Saturna. Jest to prezentowane w większej ilości na rzece Vid Flumina, która przepływa przez ponad 400 kilometrów do jednego z jej mórz. Ten związek został również dowodzony na kometach i na powierzchni Plutona.
Zastosowania etanu
Produkcja etylenu
Zastosowanie etanu opiera się głównie na produkcji etylenu, produkcie ekologicznym o większym wykorzystaniu w produkcji światowej, poprzez proces znany jako etap parowy.
Proces ten polega na przekazaniu rozcieńczonego etanu.
Reakcja występuje w wyjątkowo wysokiej temperaturze (między 850 a 900 ° C), ale czas przebywania (czas przechodzenia etanu w piekarniku) musi być krótki, aby reakcja była skuteczna. W wyższych temperaturach generuje się więcej etylenu.
Może ci służyć: neon: historia, właściwości, struktura, ryzyko, użyciaPodstawowe tworzenie chemiczne
Etano było również badane jako główny składnik w tworzeniu podstawowych chemikaliów. Chlorowanie oksydacyjne jest jednym z procesów podniesionych w celu uzyskania chlorku winylu (komponent PVC), zastępując inne mniej ekonomiczne i bardziej skomplikowane.
Chłodziwo
Wreszcie etan jest stosowany jako czynnik chłodniczy we wspólnych układach kriogenicznych, wykazując także zdolności zamrażania małych próbek w laboratorium do analizy.
Jest to bardzo dobry substytut wody, który wymaga więcej, aby schłodzić delikatne próbki, a także może generować tworzenie szkodliwych kryształów lodowych.
Ryzyko etanu
-Estano ma zdolność do zapalenia, głównie gdy dołącza do powietrza. Procent od 3,0 do 12,5% objętości etanu w powietrzu można uformować mieszaninę wybuchową.
-Może ograniczyć tlen w powietrzu, w którym się znajduje, i z tego powodu przedstawia czynnik ryzyka uduszenia dla osób i zwierząt, które są obecne i odsłonięte.
-Etan w zamrożonej formie płynnej może poważnie spalić skórę, jeśli ma z nią bezpośredni kontakt, a także działać jako kriogeniczne medium dla każdego obiektu, który dotyka, zamrażając go w chwilach.
-Opary ciekłego etanu są cięższe niż powietrze i koncentrują się na ziemi, może to stanowić ryzyko zapłonu, które może wygenerować reakcję spalania łańcucha.
-Spożycie Etano może powodować nudności, wymioty i krwotoki wewnętrzne. Wdychanie, oprócz uduszenia, powoduje bóle głowy, zamieszanie i zmiana humoru. Śmierć z powodu zatrzymania krążenia jest możliwa na wysokich wystawach.
-Reprezentuje gaz cieplarniany, który wraz z metanem i dwutlenkiem węgla przyczynia się do globalnego ogrzewania i zmian klimatu generowanych przez ludzkie zanieczyszczenie. Na szczęście jest mniej obfity i trwa niż metan i pochłania mniej promieniowania niż to.
Bibliografia
- Britannica, e. (S.F.). Etan. Uzyskane z Britannica.com
- Nes, g. V. (S.F.). Struktury pojedynczych kryształów i rozkłady gęstości elektronów etanu, etylenu i acetylenu. Dywan wyzdrowiał.Nl
- Witryny, g. (S.F.). Etan: źródła i zlewy. Uzyskane z miejsc.Google.com
- Softschools (s.F.). Formuła etanu. Odzyskane z Softschools.com
- Wikipedia (s.F.). Etan. Uzyskane z in.Wikipedia.org

