Entualpía
- 2230
- 624
- Maksymilian Kępa
Co to jest entalpia?
entualpía Jest właściwością termodynamiczną, której zmienność, w warunkach stałej temperatury i ciśnienia, określa energię kaloryczną substancji lub układu związanego z reakcją chemiczną lub procesem fizycznym. Będąc funkcją stanu, jest ona reprezentowana z literą w kapitali.
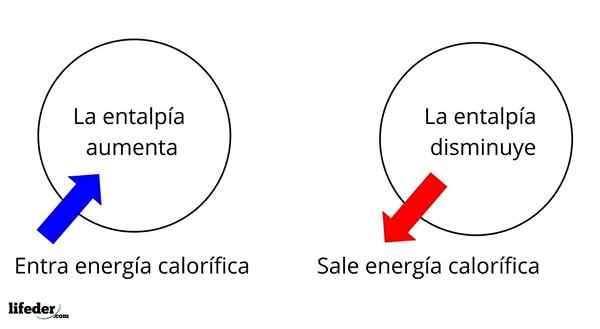
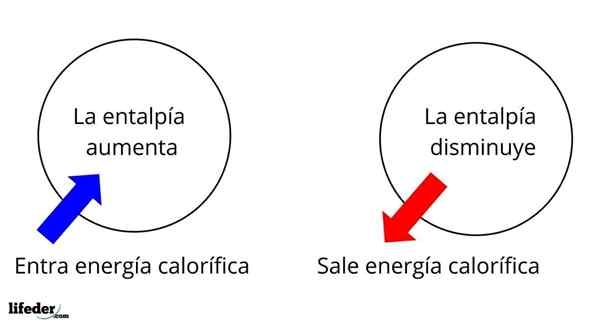
Jest to jedna z najbardziej fundamentalnych rozległych właściwości do badania termochemii wielu reakcji; Oznacza to, że mówimy o oderwaniu lub wchłanianiu ciepła między środkiem reakcji a jego otoczeniem. Zatem mówimy, że reakcja jest egzotermiczna, jeśli jej δH jest ujemna (δH 0).
 Zmiana entalpii w topnieniu lodu jest dodatnia, co wskazuje, że lód pochłania ciepło ze środowiska, aby przejść do stanu ciekłego, wody
Zmiana entalpii w topnieniu lodu jest dodatnia, co wskazuje, że lód pochłania ciepło ze środowiska, aby przejść do stanu ciekłego, wody Na przykład Ice ma entalpię, hlód, Podczas gdy woda ma również własną entalpię, hwoda. Kiedy lód się topi, zachodzi zmienność entalpii, zwana δhFus lub topnienie ciepła (hwoda-Hlód). Entalpia wody jest lepsza od lodu, powodując δHFus Bo lód jest dodatni i ma wartość +6.01 kJ/mol.
Entalpia i jej odmiana są zwykle wyrażane w jednostkach Joule lub Kalorii. Zmiana entalpii +6.01 kJ/mol wskazuje, że lód mol musi wchłonąć 6.01 kJ energii kalorii lub ciepła do stopienia.
Jak obliczana jest entalpia?
Entalpia i jej odmiana
Sama entalpia jest nieobliczalna, ponieważ zależy ona od zmiennych trudnych do dokładnie zmierzenia. Dobrym porównaniem byłoby mierzenie całkowitej objętości oceanów: zawsze będą jej części pod ziemią lub rozproszone między kontynentami. Dlatego, a w praktyce H nie można ustalić; Ale tak δh.
Może ci służyć: koloidAby osiągnąć wyrażenie matematyczne, które umożliwia obliczenie ΔH, musi być najpierw pozostawiona z podstawowej definicji entalpii:
H = u + PV
Będąc energią wewnętrzną systemu lub przedmiotowej substancji, a PV pracy na objętość ciśnienia, jaką ten system wywiera na otoczenie. Ponieważ jesteśmy zainteresowani obliczeniem ΔH i bez H, mamy:
ΔH = δu + δ (PV)
Jeśli ciśnienie jest stałe, równanie pozostanie:
ΔH = δu + pδv
Z drugiej strony wiemy, że:
Δu = Q + W
Istnienie Q ciepło i W pracują. Zastąpienie nas:
ΔH = Q + W + pδv
Ale ponadto wiemy, że:
W = - pΔv
I dlatego:
ΔH = Q - PΔV + pδv
ΔH = Q
To znaczy, HH dla reakcji lub procesu, przeprowadzonego pod stałym ciśnieniem, będzie równy ciepło Q wygenerowane lub wchłonięte.
Reakcje entalpia zmienia się
Założenie, że ciśnienie pozostaje stałe, jest możliwe, jeśli reakcja występuje w atmosferze Ziemi. Na przykład lód zimowych krajobrazów topi się bez doświadczania kolejnej presji niż w naszej atmosferze. Z drugiej strony dotyczy również reakcji w płynnych mediach lub tych, które nie wytwarzają dużych ilości gazów.
Te reakcje pochłaniają lub uwalniają ciepło Q równe δH, która z kolei jest różnicą entalpii między produktami a reagentami:
ΔH = hProdukty - HReaganty
Rodzaje entalpii
Powszechną praktyką jest mówienie o δH i H jakby były takie same: oba nazywane są entalpie. Jednak jeśli chodzi o typy, H jest unikalny dla każdej substancji lub systemu; Natomiast δH z drugiej strony podlega naturze reakcji lub procesu samodzielnie w sobie.
W tym sensie najpierw mamy pozytywne zmiany entalpii (δH> 0) lub ujemne (δH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Może ci służyć: nitrobenzen (C6H5N2): Struktura, właściwości, zastosowania, ryzykoZnak „+” lub „-”, który towarzyszy δH, mówi nam zatem, czy istnieje wyzwolenie lub wchłanianie ciepła w pewnej reakcji lub procesie; które mają charakterystykę δH, jako część ich właściwości termochemicznych.
Mamy nieskończoności rodzajów entalpie, które można klasyfikować zgodnie z procesami fizycznymi lub reakcjami chemicznymi.
Procesy fizyczne
Entalpia zmiany fazy
Substancje muszą wchłonąć lub uwalniać ciepło, aby przejść z fazy materiału lub materiału (stały, ciekł lub gaz) do innej. Na przykład lód pochłania ciepło do stopienia, więc entalpia dla tej zmiany fazy odpowiada fuzji, δhFus, Nazywany także utajonym ciepłem ciepła.
Entalpia rozpuszczania lub mieszanki
Substancje po rozpuszczeniu lub zmieszaniu w pożywce rozpuszczalnikowej mogą wchłaniać lub uwalniać ciepło, a tym samym entalpia δhDis lub δHMieszać.
Reakcje chemiczne
Entalpia treningowa
Jest to powiązane ciepło, hhºF, do tworzenia związku, w szczególności jednego mola, z jego elementów składowych w standardowych warunkach ciśnienia i temperatury (t = 298.15 K i P = 1 atm).
Entalpia rozkładu
Jest to powiązane ciepło, δhdes, do degradacji związku w mniejszych i prostych substancjach. Jest ogólnie dodatnia, ponieważ potrzebne jest ciepło do rozbicia wiązań cząsteczek.
Entalpia uwodornienia
Jest to powiązane ciepło, δhH, Do uzależnienia cząsteczki wodoru do związku, zwykle węglowodorów.
Entalpia spalania
Jest to uwalniane ciepło, hhgrzebień, Kiedy substancja spala reagowanie z tlenem. Jest ujemny, ponieważ ciepło i światło są uwalniane (ogień).
Może ci służyć: masa atomowa: definicja, typy, jak ją obliczyć, przykładyPrzykłady entalpie
Wreszcie, zostaną wprowadzone o niektórych konkretnych przykładach entalpii:
Spalanie metanu
Ch4 + 22 → CO2 + 2h2ALBO
ΔH = -890.3 kJ/mol
To znaczy jeden mol cho4 Kiedy spalanie wyzwala 890.3 kJ energii kalorycznej.
Uwodornienie etylenu
Ch2= Ch2 + H2 → CH3Ch3
ΔH = -136 kJ/mol
Mole etylenu uwalnia 136 kJ ciepła, gdy wodór stał się etanem.
Sól w wodzie
Sól stołowa, NaCl, rozpuszcza się w wodzie, aby oddzielić jony NA+ i Cl- sieci krystalicznych i otoczenia (hydrat) cząsteczek wody:
NaCl (y) → na+(AC) + Cl-(AC)
ΔH = +3.87 kJ/mol
To znaczy rozpuszczająca się sól w wodzie, odpowiednio w celu ochłodzenia szkła lub pojemnika. Jednak pochłonięta ilość ciepła jest bardzo mała, więc nasze ręce odczuwają tylko niewielką zmianę temperatury.
Rozpuszczanie chloranu potasu w wodzie
Z drugiej strony chloran potasowy, kclo3, Ma δhDis bardzo pozytywny:
Kcl3(s) → k+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
Co oznacza, że rozpuszczenie w wodzie pochłania się bardzo gorąco. I dlatego pojemnik znacznie ostygnie i zobaczymy, że otaczająca para wodna zwilkuje jego zewnętrzną powierzchnię.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Entalpia. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (28 sierpnia 2020). Definicja entalpii w chemii i fizyce. Odzyskane z: Thoughtco.com
- Andrew Rader Studios. (2015). Energia i entalpia. Odzyskane z: Physics4Kids.com
- Kiddle. (2020). Fakty entalpii dla dzieci. Źródło: fakty.Kiddle.współ
- Admin. (21 grudnia 2010). Entalpia. Odzyskane z: oksyorganic chemikalia.com
- María Estela Raffino. (11 lipca 2020 r.). Koncepcja Entalpia. Odzyskane z: koncepcja.z

