Wiązanie kowalencyjne
- 708
- 177
- Maksymilian Kępa
Co to jest kowalencyjny link?
Wiązanie kowalencyjne jest silną interakcją, która pozwala na połączenie dwóch lub więcej atomów w celu utworzenia cząsteczek. Jest to jeden z rodzajów wiązań chemicznych, w których uczestniczy kilka elektronów pochodzących z najbardziej zewnętrznych orbitali atomów, które są.
Teoretycznie każdy atom przyczynia się do jednego z dwóch elektronów podczas łączenia kowalencyjnego, tak że zdobyli stabilność. Para elektronów, które stają się rodzajem „elektronicznego haka” między dwoma jądermi atomowymi, jest równo dzielona między dwoma identycznymi atomami, ale nie dzieje się tak, gdy dwa atomy mają dwa różne elementy.
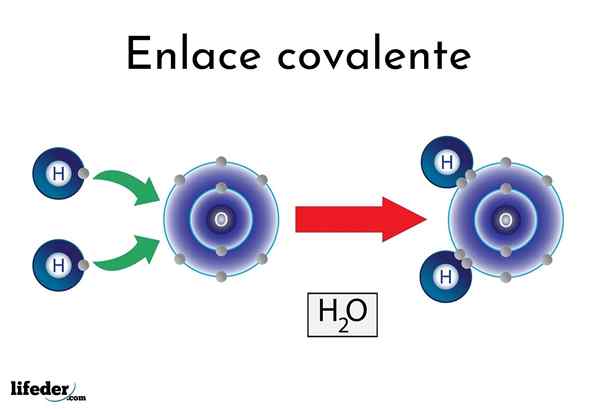
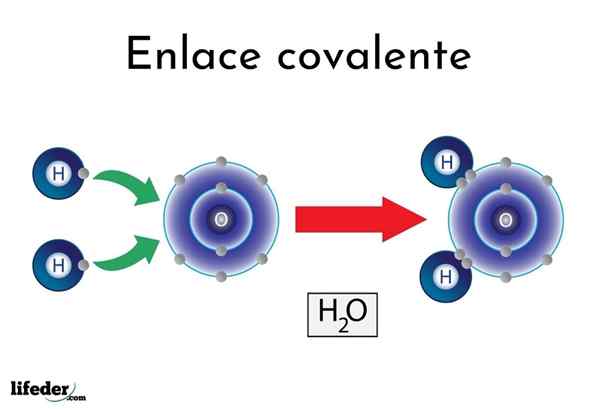 Wodne wiązanie
Wodne wiązanie Istnieją atomy lub elementy, które mają naturalną tendencję do tworzenia elektronów, podczas gdy inni wolą je wygrać.
Na przykład słynna cząsteczka wody, h2Lub ma dwa kowalencyjne linki: H-O-H. Hydrogeny i tlen dzielą dwie pary elektronów, ale te orbita bliżej atomu tlenu niż wodór. To zjawisko jest spowodowane polaryzacją i elektroonywnością.
Charakterystyka wiązań kowalencyjnych
Kowalencyjne wiązania przedstawiają następujące cechy:
-Obejmują one kilka elektronów dla każdego kowalencyjnego wiązania.
-Jego długości są zwykle wyrażane w jednostkach PM (pikometry) lub Armstrong (Å).
-Są trudne do złamania, co oznacza, że są bardzo silne.
-Kiedy pękają, występują zmiany lub transformacje chemiczne, ponieważ cząsteczka tracą atomy. W tym procesie energia jest wchłaniana.
-Kiedy się tworzą, rodzi się nowa cząsteczka. W tym procesie jest uwalniana energia.
Może ci służyć: reakcje chemiczne: cechy, części, typy, przykłady-Jego długości różnią się w zależności od zachłodności, jaką jeden z połączonych atomów ma w stosunku do pary elektronów; To znaczy, im bardziej go przyciąga, kowalencyjny link jest wydłużony.
-Najprostsze wiązania kowalencyjne istnieją tylko między dwoma atomami jednocześnie i są reprezentowane za pomocą skryptu lub linii (-).
Istnieją inne funkcje, które dotyczą bardziej złożonych linków kowalencyjnych, które jednak są również zgodne z tym, co skomentowane powyżej.
Rodzaje kowalencyjnych linków
Wiązania kowalencyjne można zasadniczo klasyfikować na dwa sposoby: zgodnie z liczbą współdzielonych elektronów i zgodnie z wynikową polaryzacją po utworzeniu cząsteczki. Oba zostaną opisane powierzchownie poniżej.
Zgodnie z liczbą wspólnych elektronów
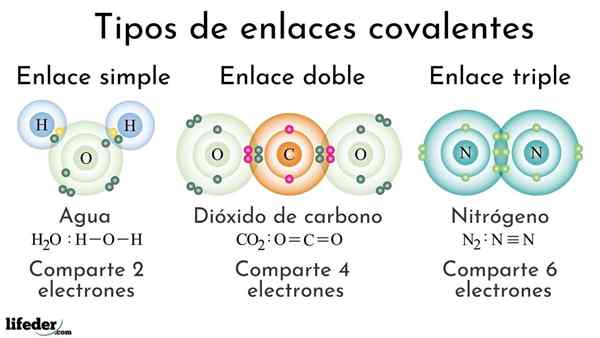 Rodzaje wiązań kowalencyjnych zgodnie z liczbą wspólnych elektronów
Rodzaje wiązań kowalencyjnych zgodnie z liczbą wspólnych elektronów Obligacje kowalencyjne zgodnie z liczbą wspólnych elektronów można zaklasyfikować jako proste, podwójne lub potrójne. Na górnym obrazie te odpowiednie linki dla trzech cząsteczek, które zostaną omówione poniżej, pokazano.
-
Prosty
Proste wiązanie kowalencyjne to takie, w których jest tylko kilka elektronów, to znaczy dwa elektrony. Przykład tego linku, który widzimy w cząsteczce wody, h, h2ALBO. Zauważ, że spośród wszystkich kowalencyjnych więzi, proste, I-i, jest najdłuższe ze wszystkich. To prawie zawsze.
-
Podwójnie
W podwójnym wiązaniu kowalencyjnym, jak sama nazwa wskazuje, dwie pary elektronów, co oznacza, że istnieją cztery elektrony, które wzmacniają „elektroniczny hak” między dwoma połączonymi atomami.
To znaczy podwójne wiązanie (=) jest silniejsze niż prosty (-). Jest to jednak bardziej reaktywne, co, choć może wydawać się sprzeczne, jest łatwe do wyjaśnienia, biorąc pod uwagę nakładanie się orbitali atomowych.
Może ci służyć: polarność (chemia): co to jest, definicja, przykładyPrzykład tego linku jest widoczny w cząsteczce dwutlenku węgla, co2. Dwa atomy tlenu pozostają silnie zjednoczone z węglem dzięki temu wiązaniu, OR = C = O, które za silniejsze, bliżej atomów; A to z kolei prowadzi do skrócenia linku.
-
Potroić
Triple Link jest najsilniejszym i najkrótszym z kowalencyjnych wiązań (wspólne). Zauważ, że dla cząsteczki azotu n2 lub N≡N, ich atomy reprezentowane przez niebieskawe kule są bardzo blisko siebie.
W linku potrójnym mamy trzy parę elektronów, co jest równe sześciu elektronom, które wzmacniają wiązanie kowalencyjne między dwoma atomami.
-
Celownik
Link skrajny jest specjalnym rodzajem prostego linku, który składa się z pary elektronów. Oznacza to, że można to postrzegać jako „wymuszone udostępnianie”.
Na przykład cząsteczka m2Lub użyj jednej z pary bez tlenu, aby przekazać je na jon h+ (H2O: → H+ = [H2OH]+ lub h3ALBO+).
Według polaryzacji
Wiązania kowalencyjne według polaryzacji można zaklasyfikować jako polarne kowalencyjne lub kowalencyjne.
-
Polarne wiązania kowalencyjne
Występuje między dwoma różnymi atomami, których różnica elektroungatywności jest duża. Powoduje to powstawanie dipolu, w którym atom koncentruje się negatywnie (przyciąga elektron), podczas gdy drugi koncentruje się pozytywnie (daje elektrony). Na przykład wiązanie kowalencyjne HF (H-F) jest polarne, ponieważ fluorek jest bardziej elektrowni niż wodór.
-
Niepolarne kowalencyjne łącza
Występuje między dwoma identycznymi atomami, których różnica w elektroonywatywności wynosi zero lub bardzo małe. Cząsteczki wspomniane powyżej: i2, ALBO2 oraz n2 Prezentują niezolarne wiązania kowalencyjne. Dlatego elektrony są wokół obu atomów o tej samej częstotliwości.
Może ci służyć: uretan: struktura, właściwości, uzyskiwanie, użyciaPrzykłady kowalencyjnych linków
Wreszcie, inne kowalencyjne obligacje zostaną wymienione oprócz tych już wyjaśnionych, co wskazuje również na ich typy:
H2S (H-S-H), proste polarne kowalencyjne | HCl (H-Cl), polarne proste kowalencyjne łącze |
H2 (H-H), a nie polarne proste kowalencyjne | C2H4 (H-C≡C-H), z dwoma prostymi linkami polarnymi (C-H) i potrójnym niepolarnym łączem (C≡C) |
F2 (F-F), prosty kowalencyjny | P2 (str≡P), kowalencyjne wiązanie nietopolarne (lub apolarne) |
Co₂ (o = c = o), podwójny polarny kowalencyjny | S2 (S = s), nietwarte podwójne wiązanie kowalencyjne |
HCN (H-C≡N), z prostym polarnym wiązaniem kowalencyjnym (H-C) i kolejnym potrójnym linkiem polarnym (c≡N) | NH3 (N-H), z trzema prostymi polarnymi wiązaniami kowalencyjnymi |
Cytowane przykłady odpowiadają małym cząsteczkom. Ale wiązania kowalencyjne są obecne we wszystkich istniejących cząsteczkach, w tym polimerach, biomolekułach, makrocząsteczkach, minerałach, ceramice, węglowodorach, między innymi.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- María Estela Raffino. (28 czerwca 2020). Wiązanie kowalencyjne. Pojęcie.z. Odzyskane z: koncepcja.z
- Wikipedia. (2020). Wiązanie kowalencyjne. Źródło: w:.Wikipedia.org
- Kamy Fung & Nima Mirzaee. (15 sierpnia 2020). Wiązania kowalencyjne. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Helmestine, Anne Marie, pH.D. (27 sierpnia 2020). Co to jest kowalencyjna wiązanie w chemii? Odzyskane z: Thoughtco.com

