Struktura kapsułki Bowmana, histologia, funkcje
- 2823
- 459
- Arkady Sawicki
Bowman Capsule Reprezentuje początkowy segment elementu rurowego Nefronu, anátomo-funkcjonalnej jednostki nerki, w której procesy przeznaczone do produkcji moczu są przeprowadzane i z którym nerka przyczynia się do ochrony homeostazy organizmu.
Został nazwany na cześć angielskiego okulisty i anatomisty Sir Williama Bowmana, który odkrył swoje istnienie i opublikował swój opis histologiczny po raz pierwszy w 1842 roku.
 Ilustracja nefronu (Źródło: dzieła Holly Fischer [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] przez Wikimedia Commons)
Ilustracja nefronu (Źródło: dzieła Holly Fischer [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] przez Wikimedia Commons) W literaturze istnieje pewne zamieszanie w odniesieniu do nomenklatury początkowych segmentów Nefronu, wśród których dołączono kapsułę Bowmana. Czasami jest opisywany jako inna część kłębuszków i stanowi z nim korpus nerkowy, podczas gdy dla innych działa jako członek Glomerulus.
Niezależnie od faktu, że w opisach anatomicznych kapsułka jest częścią kłębuszków, faktem jest, że oba elementy są tak ściśle związane ze swoją strukturą i funkcją, że termin Glomerulus budzi się w tym, kto myśli o tym, że pomysł sferki z nim naczynia.
Jeśli nie, kapsuła byłaby po prostu gniazdą, w którym wlewa się płyn przefiltrowany w kłębuszkach, ale nie miałby części w tym samym procesie filtracji kłębuszkowej. Co tak nie.
[TOC]
Struktura i histologia
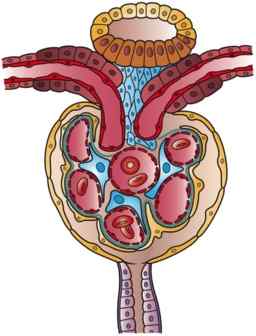
Kapsuła Bowmana jest jak maleńka kula, której ściana jest inwazją w sektorze naczyniowym. W tej inwazji kapsułka jest penetrowana przez przekąskę do włosów, która pochodzi z aferentnej tętnicy i która przynosi krew do kłębuszków, gdzie pojawia się również oszałamiająca tętniczka, która zabiera krew z kłębuszków kłębuszkowych.
Przeciwny koniec kapsułki, zwany biegunem moczowym, jest przedstawiany tak, jakby ściana kuli miała otwór, do którego koniec pierwszego segmentu, który rozpoczyna samą funkcję kanalikową, to znaczy podłączona jest proksymalna skonstruowana kanalika.
Ta zewnętrzna ściana kapsułki jest płaskim nabłonkiem i nazywa się nabłonkiem ciemieniowym kapsułki Bowmana. Zmień strukturę podczas przejścia do nabłonka bliższego kanalików w biegunie moczowym i w kierunku nabłonka trzewnego w biegunie naczyniowym.
Może ci służyć: brodawki grzybowateNamożyony nabłonek nazywa się trzewnym, ponieważ owija kłębuszki naczyń włosowatych, tak jakby były wnętrznościami. Powstaje go komórki zwane podocytami, które obejmują je, pokrywając je, na włosownikach i które mają bardzo szczególne cechy.
Podocyty są zorganizowane w pojedynczej warstwie, emitując przedłużenia, które kolidują z rozszerzeniami sąsiednich podocytów, pozostawiając przestrzenie między nimi zwane porami w szczelinach rozszczepu lub filtracji i które są rozwiązaniami ciągłości na etapie filtrowania.
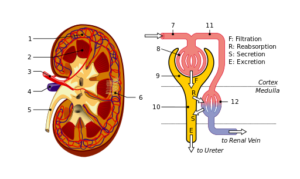 Struktura nerki i nefronu: 1. Kora nerkowa; 2. Szpik kostny; 3. Tętnica nerkowa; 4. Żyły nerkowe; 5. Moczowód; 6. Nefronowie; 7. Aferentna arteriola; 8. Glomerulus; 9. Bowman Capsule; 10. Rule i Hanle tak; jedenaście. Kapilary otrzewnowe (źródło: Plik: Plik: Physiology_Of_Nephron.SVG: Madhero88File: nerp.SVG: Piotr Michał Jaworski; PIOM W PLLIDERIVATIVE PRACY: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Struktura nerki i nefronu: 1. Kora nerkowa; 2. Szpik kostny; 3. Tętnica nerkowa; 4. Żyły nerkowe; 5. Moczowód; 6. Nefronowie; 7. Aferentna arteriola; 8. Glomerulus; 9. Bowman Capsule; 10. Rule i Hanle tak; jedenaście. Kapilary otrzewnowe (źródło: Plik: Plik: Physiology_Of_Nephron.SVG: Madhero88File: nerp.SVG: Piotr Michał Jaworski; PIOM W PLLIDERIVATIVE PRACY: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Podocyty i komórki śródbłonka, które obejmują błonę podstawową, na której wspierają, a także mają roztwory ciągłości przejścia wody i substancji. Komórki śródbłonka to fenestradas, a także pozwalają na filtrację.
Tak więc te trzy elementy: śródbłonek naczyń włosowatych, błona podstawy i nabłonek trzewny kapsułki Bowmana, stanowią razem barierę błony lub filtrację.
Funkcje
Kapsułka jest powiązana z procesem filtracji kłębuszkowej. Z jednej strony, ponieważ jest częścią pokrywy nabłonkowej podocytów otaczających kłębuszki naczyń włosowatych. Przyczynia się również do syntezy błony podstawnej, na której obsługiwane jest ten nabłonek i śródbłonek naczyń włosowatych.
Te trzy struktury: śródbłonek naczyń włosowatych, błona podstawa i nabłonek trzewna kapsułki Bowmana, stanowią barierę błonową lub filtracyjną SAM, a każda z nich ma swoje własne charakterystyki przepuszczalności, które przyczyniają się do globalnej selektywności tej bariery.
Ponadto objętość płynu, która przenika w przestrzeń Bowmana, wraz ze stopniem sztywności przeciwnej ściany zewnętrznej torebki, określa genezę ciśnienia wewnątrzprawnego, które pomaga modulować efektywne ciśnienie filtracyjne i zwiększyć ciecz w powiązanym kanalidzie.
Może ci służyć: periosteum: Charakterystyka, funkcje i histologiaDeterminanty wielkości filtracji kłębuszkowej
Zmienną, która zbiera wielkość procesu filtracji kłębuszkowej, jest tak zwana objętość filtracji kłębuszkowej (VFG), która jest objętością cieczy, która jest filtrowana we wszystkich kłębuszkach w jednostce czasowej. Jego średnia wartość normalna wynosi około 125 ml/min lub 180 l/dzień.
Wielkość tej zmiennej jest określana na podstawie fizycznego punktu widzenia przez dwa czynniki, a mianowicie współczynnik filtracji lub ultrafiltracji (KF) i efektywne ciśnienie filtracyjne (PEFF). To znaczy: vfg = kf x peff (równanie 1)
Współczynnik filtracji (kF)
Współczynnik filtracji (KF) jest iloczyn przewodności hydraulicznej (LP), który mierzy przepuszczalność wody membrany w ml/min na jednostkę powierzchni i jednostkę ciśnienia implementacyjnego, według powierzchni (a) membrany filtracyjnej, to znaczy kf = lp x a (równanie 2).
Wielkość współczynnika filtracji wskazuje objętość filtrowanego płynu na jednostkę czasu i na jednostkę napędu efektywnego. Chociaż jest bardzo trudne do zmierzenia, można go uzyskać z równania 1, dzieląc VFG/PEFF.
KF w naczyniach włosowych kłębuszkowych wynosi 12,5 ml/min/mmHg na c/100 g tkanki, o wartości około 400 razy wyższych niż kf innych układów kapilarnych korpusu, gdzie można filtrować około 0,01 ml/min/mm Hg na 100 g materiału. Porównanie pokazujące skuteczność filtrowania kłębuszkowego.
Skuteczne ciśnienie filtracyjne (PEFF)
Efektywne ciśnienie filtracyjne reprezentuje wynik algebraicznej sumy różnych sił ciśnienia, które sprzyjają lub przeciwstawiają się filtracji. Istnieje hydrostatyczny gradient ciśnienia (ΔP) i inne ciśnienie osmotyczne (onkotyczne, δп) określone przez obecność białek w osoczu.
Gradient ciśnienia hydrostatycznego to różnica ciśnienia między wewnętrzną kapilarą kłębuszkową (PCG = 50 mm Hg) a przestrzenią kapsułki Bowmana (PCB = 12 mm Hg). Jak widać, gradient ten jest skierowany z kapilary do kapsułki i promuje w tym względzie przemieszczenie płynu.
Może ci służyć: szkielet wyrostka robaczkowego: funkcje i kościGradient ciśnienia osmotycznego przesuwa ciecz mniejszy do wyższego ciśnienia osmotycznego. Tylko cząstki, które nie filtrują, wywierają ten efekt. Białka nie filtrują. Jego пcb wynosi 0, a w stawu kapilarnym пcg jest to 20 mm hg. Ten gradient przesuwa ciecz z kapsułki do kapilary.
Ciśnienie efektywne można obliczyć poprzez zastosowanie PEFF = δP-δп; = (Pcg-pcb)-(пcg-pscb); = (50-12)-(20-0); = 38-20 = 18 mm Hg. W związku z tym istnieje efektywne lub netto ciśnienie filtracyjne wynoszące około 18 mm Hg, które określa VFG około 125 ml/min.
Wskaźnik filtracji (if) substancji obecnych w osoczu
Jest to wskaźnik łatwości (lub trudności), z jaką substancja obecna w osoczu może przekroczyć barierę filtracyjną. Wskaźnik uzyskuje się przez podzielenie stężenia substancji na filtrowanie (FX) między jej stężeniem w osoczu (PX), to znaczy: ifx = fx/ px.
Zakres wartości IF wynosi między maksymalnie 1 dla tych substancji, które filtrują swobodnie, a 0 dla tych, którzy niczego nie filtrują. Wartości pośrednich dotyczą cząstek o trudnościach pośrednich. Im bliżej 1 wartości, tym lepsza filtracja. Bliżej 0, trudniej do filtrowania.
Jeden z czynników, który określa IF jest wielkość cząstki. Te, które mają średnice mniej niż 4 nm filtr swobodnie (jeśli = 1). Gdy rozmiar rośnie i zbliża się do albuminy, FE jest zmniejszone. Cząstki wielkości albuminy lub większe, mają 0 ifs 0.
Kolejny czynnik, który pomaga określić IF, to ujemne obciążenia elektryczne na powierzchni molekularnej. Białka mają duże obciążenie ujemne, które są dodawane do ich wielkości, aby utrudnić ich filtrowię. Powodem jest to, że pory mają negatywne ładunki, które odpychają zalety białek.
Bibliografia
- Ganong WF: funkcja nerkowa i micturition, w Przegląd fizjologii medycznej, 25. edycja. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Układ moczu, w Podręcznik fizjologii medycznej , 13th Ed, AC Guyton, Je Hall (red.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, w Physiologie des Menschen roztoczy patofizjologa, 31 TH ED, RF Schmidt i in. (Eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die Funkction der Nieren, w Fizjologia, 6. edycja; R Klinke i in. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak i in.: Niere untoitende Harnwege, w Klinche patofiziologie, 8th Ed, W Siegenthaler (red.). Stuttgart, Georg Thieme Verlag, 2001.
- « Jakie są włókniste stawy? Typy i cechy
- Pochodzenie baragonnozji, koncepcja, test, pokrewne zaburzenia »

