Chlorek cyny (ii)
- 3532
- 633
- Maksymilian Kępa
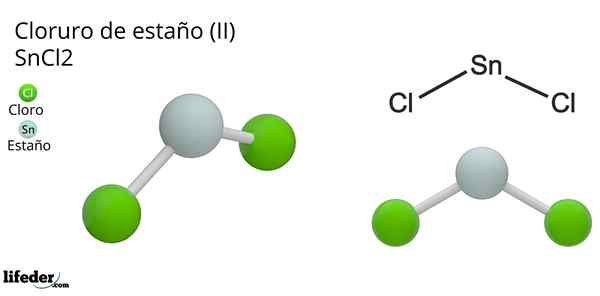
On Chlorek cyny (Ii) lub niewielki chlorek, wzoru chemicznego SNCL2, Jest to biały i krystaliczny stały związek, produkt reakcji cyny i stężony roztwór kwasu chlorowodorowego: Sn (s) + 2HCl (conc) => snc2(aq) + h2(G). Proces jego syntezy (przygotowanie) polega na dodaniu elementów TIN do reakcji z kwasem.
Po dodaniu kawałków cyny, odwodnienie i krystalizacja jest przeprowadzana, aż do uzyskania soli nieorganicznej. W tym związku cyna straciła dwa elektrony swojej warstwy walencyjnej, tworząc połączenia z atomami chloru.
Można to lepiej zrozumieć, czy rozważana jest konfiguracja Tin Valencia (5s25 pX2PI0Pz0), z których para elektronów zajmujących orbital pX jest przypisany do protonów h+, w celu utworzenia dwuatomicznej cząsteczki wodoru. Oznacza to, że jest to reakcja typu redoks.
[TOC]
Właściwości chlorku cyny
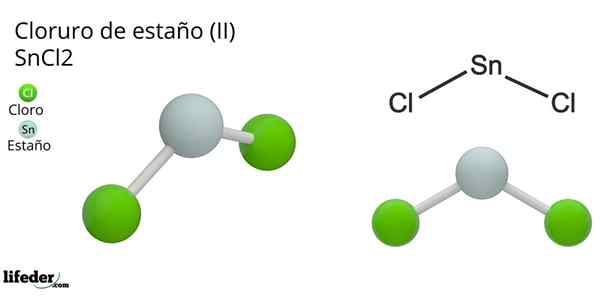
 Chlorek cyny (ii) dihydrat
Chlorek cyny (ii) dihydrat Linki SNCL2 Są typem jonowym lub kowalencyjnym? Fizyczne właściwości chlorku cyny (ii) odrzucają pierwszą opcję. Punkty fuzji i wrzenia dla tego związku wynoszą 247 ° C i 623 °.
Jego kryształy są białe, co przekłada się na zerową wchłanianie w widmie widzialnym.
Konfiguracja Valencia
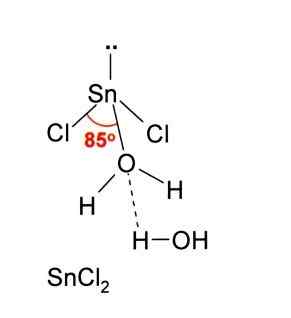
Na powyższym obrazku ilustruje izolowana mennica snick2.
Geometria molekularna powinna być płaska, ponieważ hybrydyzacja atomu centralnego jest spoś2 (3 Orbitale SP2 i czysty orbitalny do tworzenia wiązań kowalencyjnych), ale moment obrotowy pozbawiony elektronów zajmuje objętość i popycha atomy chloru, co daje cząsteczce geometrii kątowej.
W fazie gazowej związek ten jest izolowany, więc nie oddziałuje z innymi cząsteczkami.
Może ci służyć: saponifikacjaJako utrata pary elektronów na orbicie pX, Cyna przekształca się w jon sN2+ a jego wynikowa konfiguracja elektroniczna wynosi 5s25 pX0PI0Pz0, Ze wszystkimi swoimi orbitalami do zaakceptowania linków od innych gatunków.
Jony CL- Koordynują z jonem SN2+ Aby powstrzymać chlorek cyny. Konfiguracja cyny elektronicznej w tej soli to 5s25 pX2PI2Pz0, Możliwość zaakceptowania kolejnej pary elektronów na darmowej orbicie pz.
Na przykład możesz zaakceptować inny jon cl-, tworzenie trygonalnego kompleksu geometrii płaskiej (trójkątna piramida zasady) i negatywnie załadowana [SNCL3]-.
Reaktywność
SNCL2 Ma wysoką reaktywność i trend, aby zachowywać się jak kwas Lewis (receptor elektronowy), aby ukończyć okT w Walencji.
A także zaakceptuj jon cl-, To samo dotyczy wody, która „nawilża” atom cyny, gdy cząsteczka wody jest połączona bezpośrednio z puszką, a druga cząsteczka wody tworzy interakcje przez mosty wodorowe z pierwszym.
Wynikiem tego jest to, że sncl2 Nie jest czysty, ale skoordynowany z wodą w jej podeszwanej soli: SNCL2· 2H2ALBO.
SNCL2 Jest bardzo rozpuszczalny w wodzie i rozpuszczalnikach polarnych, ponieważ jest to związek polarny. Jednak jego rozpuszczalność w wodzie, mniejsza niż masa masy, aktywuje reakcję hydrolizy (pęknięcie cząsteczki wody) w celu wytworzenia podstawowej i nierozpuszczalnej soli:
Sncl2(aq) + h2Lub (L) Sn (OH) Cl (s) + HCl (aq)
Podwójna strzałka wskazuje, że równowaga jest ustalana, uprzywilejowana w lewo (w kierunku odczynników), jeśli stężenia HCl wzrosną. Dlatego rozwiązania SNCL2 Pracownicy mają kwaśne pH, aby uniknąć wytrącania niechcianego produktu solnego hydrolizy.
Może ci służyć: nukleofil: atak nukleofilowy, typy, przykłady, nukleofilnośćAktywność redukcyjna
Reaguje z tlenem powietrza, tworząc chlorek cyny (IV) lub chlorek to:
6 Sncl2(aq) + o2(g) + 2h2Lub (l) => 2SNCL4(aq) + 4Sn (OH) Cl (s)
W tej reakcji cyna utlenia powiązanie z elektrownizującym atomem tlenu i zwiększa liczbę wiązań z atomami chloru.
Ogólnie rzecz biorąc, atomy elektroungatywne halogenów (F, Cl, Br i I) stabilizują powiązania związków Sn (IV) i ten fakt wyjaśnia, dlaczego SNCL2 jest agentem redukującym.
Po utlenianiu i traci wszystkie elektrony walencyjne, jon SN4+ to konfiguracja 5s05 pX0PI0Pz0, Będąc parą elektronów na orbicie 5s najtrudniejszą do „zabrania”.
Struktura chlorku chlorku cyny
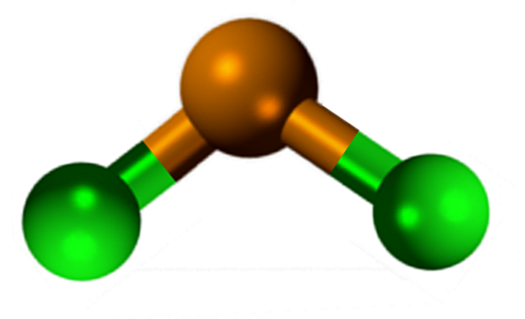 Struktura chlorku cyny (ii)
Struktura chlorku cyny (ii) SNCL2 Prezentuje krystaliczną strukturę typu ortorrombicznego, podobną do rzędów Serruchos, w których końcówki zębów są chlorkami.
Każdy rząd to łańcuch SNCL3 tworząc most CL z innym atomem SN (CL-SN (CL)2-Cl- ···). Dwa łańcuchy, wraz ze słabymi interakcjami typu Sn-Cl stanowią warstwę układu, która nakłada.
Darmowa para elektronów 5s2 Powodować zniekształcenie w strukturze, ponieważ zajmuje objętość (objętość chmury elektronicznej).
SN może mieć numer koordynacyjny równy dziewięciu, co jest tak samo jak posiadanie dziewięciu sąsiadów, rysując trygonalny pryzmat z tym zlokalizowanym na środku figury geometrycznej i CL w wierzchołkach, oprócz innych CL zlokalizowanych w każdym z każdego z każdego z każdego z nich znajdujących się w każdym kwadratowe twarze pryzmatu.
Może ci służyć: hydraceŁatwiej jest to zaobserwować, jeśli jest uważane za łańcuch, w którym skieruj się Sn (ciemnoszare kule), a trzy CL połączone z tą formą trójkątną podłogę, podczas gdy trzej klienci tworzą górny trójkątny dach.
Używa/aplikacje
W syntezie organicznej jest stosowany jako czynnik redukujący aromatyczne związki nitro (AR-no2 à ar-nh2). Ponieważ jego struktura chemiczna jest laminarna, znajduje się w świecie katalizy reakcji organicznych, oprócz tego, że jest potencjalnym kandydatem do wsparcia katalitycznego.
Jego właściwość redukująca jest wykorzystywana w celu ustalenia obecności złotych związków, w celu pokrycia szkła srebrnymi lusterkami i służenia jako przeciwutleniacz.
Również w geometrii molekularnej trygonalnej piramidy (: SNX3- M+) jest stosowany jako podstawa Lewisa do syntezy ogromnej liczby związków (takich jak kompleks klastra PT3Sn8Cl20, gdzie para wolna od elektronów jest skoordynowana z kwasem Lewisa).
Ryzyko
SNCL2 Możesz uszkodzić białe krwinki. Jest to żrące, irytujące, rakotwórcze i ma wysoki negatywny wpływ na gatunki zamieszkujące ekosystemy morskie.
Może rozkładać się w wysokich temperaturach, uwalniając szkodliwy gaz chloru. W kontakcie z bardzo utleniającymi środkami wyzwala reakcje wybuchowe.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. W Elementy grupy 14 (czwarta edycja., P. 329). MC Graw Hill.
- Chemikalia. (2017). Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Chlorek cyny. Pubchem odzyskał: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2017). Chlorek cyny (ii). Wikipedia wyzdrowiała: w.Wikipedia.org
- F. Hulliger. (1976). Chemia strukturalna faz warstwowych. P-120,121. D. Reidel Publishing Company.

