Kwasy i zasady różnice, charakterystyka, przykłady
- 1125
- 35
- Prokul Woliński
kwasy i zasady Są to związki chemiczne, które nie przedstawiają jednej definicji, ale kilka, które zależą od cech lub właściwości wzięte pod uwagę. Ogólnie rzecz biorąc, można powiedzieć, że kwasy są substancjami kwaśnymi, podczas gdy podstawami są saponáceas lub mydła.
Najważniejsze definicje, takie jak Brönsted-Lowry lub Arrhenius, koncentrują się bardziej na uwolnieniu jonów H3ALBO+ (Hydron) u oh-(hydroksyl) przez te substancje. Albo w czystych lub rozpuszczonych postaciach w wodzie.
Definicja, która powstaje w wyniku powyższego, jest następująca: kwasy rozpuszczane w wodzie wytwarzają roztwory o wartościach pH mniejszymi niż 7, podczas gdy rozpuszczone zasady wytwarzają roztwory o wartościach pH większych niż 7. PH jest dokładnie sposobem na wyrażenie kwaśnego lub podstawowego jest ciecz, biorąc pod uwagę stężenie h3ALBO+.
Dlatego substancje kwaśne, takie jak sok pomarańczowy, mają pH mniejsze niż 7 i wiele jonów H3ALBO+. Podczas gdy podstawy, takie jak Legía, mają pH większy niż 7 i wiele jonów OH-.
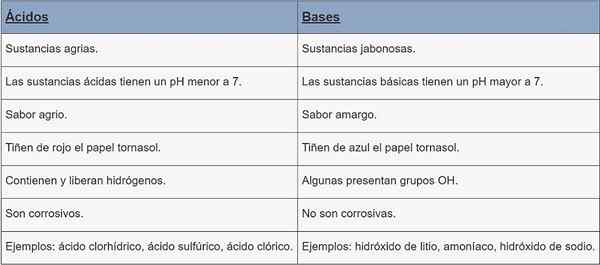
Kwasy | Bazy | |
Rodzaj substancji | Substancje rolne. | Substancje Jabonesas. |
Ph | PH mniej niż 7. | PH większe niż 7. |
Smak | Kwaśny. | Gorzki. |
Barwiący | Czerwony papier zlewnia. | Barwnik papieru Cornstasol Blue. |
Charakterystyka | Zawierają i uwalniają hydrogeny. | Niektóre obecne grupy OH. |
Korozja | Są żrące. | Nie są żrące. |
Przykłady | Kwas chlorowy, kwas siarkowy, kwas chlorowy. | Wodorotlenek litu, amoniak, wodorotlenek sodu. |
Kwasy
 Sok pomarańczowy jest jednym z najbardziej znanych przedstawicieli kwasu naszego codziennego życia
Sok pomarańczowy jest jednym z najbardziej znanych przedstawicieli kwasu naszego codziennego życia Charakterystyka kwasu
Substancje kwasowe mają pewne cechy:
Kwaśny smak
Kwasy mają kwaśny smak. Rutynowo rodzaj smaku jest oznaczony terminem „kwas”. Mówi się zatem, że sok z cytryny i ciecz niektórych gumy są kwasami, ponieważ jego smaki są kwaśne i mocne dla podniebienia.
Czerwony papier zlewnia
Kwasy to substancje zdolne do przekształcenia koloru niebieskiego na czerwony papier sprayowy. Showasol jest częścią zestawu substancji, które mogą zmieniać kolor w zależności od stopnia kwasowości lub zasadności środowiska, w którym się znajdują. Substancje te nazywane są wskaźnikami pH.
Może ci służyć: właściwości kajgodowate rozwiązańZawierają i uwalniają hydrogeny
Kwasy to związki chemiczne, które mają element chemiczny wodoru (H), co nadaje mu charakterystykę jego kwasowości.
Wiele innych substancji zawiera również wodór, ale nie mogą go uwolnić, jak to się dzieje z kwasami. Podczas uwalniania wodór jest w postaci jonów lub cation+. Te h+, Podczas spotykania cząsteczek wody są one do nich dodawane, aby utworzyć jony H3ALBO+.
Transportują prąd elektryczny
Z powodu atomów H+ które są uwalniane, gdy kwasy w wodzie są rozpuszczone, są one w stanie transportować energię elektryczną za pomocą akumulatorów lub akumulatorów.
Są żrące
Istnieją silne kwasy, które są bardzo żrące. Dlatego należy unikać kontaktu z nimi, ponieważ mogą one powodować poważne uszkodzenia fizyczne. Nawet słabe kwasy, w bardzo wysokich stężeniach, takie jak ocowa (ocet), mogą spalić skórę i gardło, jeśli ich opary są oddychane.
Silny i słaby
Silne kwasy wytwarzają duże stężenie jonów H3ALBO+ Kiedy rozpuszczają się w wodzie. Mówi się, że atomy wodoru silnych kwasów łatwo się dysocjują. Tymczasem słabe kwasy uwalniają kilka atomów wodoru, a zatem wytwarzają niższe stężenie jonów H3ALBO+.
Silne kwasy mają bardzo niskie pH, które w zależności od stężenia i siły kwasu może być 1 lub mniej. Zamiast tego słabe kwasy mają wyższe kwaśne pH, które mogą być na przykład 4 lub 5.
Mocne kwasy mają zapach, który powoduje spalanie. Tymczasem słabe kwasy nie przedstawiają tego rodzaju zapachu, nawet w niektórych przypadkach mają przyjemne zapachy. Istnieje jednak wiele wyjątków, więc nie zaleca się, aby wąchać nawet słabe kwasy.
Może ci służyć: tlenek żelaza (iii): struktura, nomenklatura, właściwości, zastosowaniaSilne kwasy to dobre transportery energii elektrycznej. Przeciwnie, słabe kwasy są złymi przewodami energii elektrycznej poprzez uwalnianie kilku atomów H+.
Silne kwasy są w stanie atakować metale, takie jak cynk, tworząc dużą liczbę pęcherzyków wodorowych. Ta reakcja nie jest wytwarzana przez słabe kwasy.
Przykłady kwasów
Silne kwasy
-HCL: kwas chlorowodorowy
-H2południowy zachód4: Kwas Siarkowy
-HBR: kwas bromhydowy
-Cześć: kwas jodhydowy
-Hno3: kwas azotowy
-Hclo4: kwas nadchlorowy
-Hclo3: Kwas chlorowy
Słabe kwasy
-Ch3COOH: kwas octowy
-Hno2: Kwas azotowy
-H2WSPÓŁ3: Kwas węglowy
-H3PO4: Kwas fosforowy
-C3H5O (COOH): kwas cytrynowy
-HF: kwas fluorowy
-H2południowy zachód3: Kwas siarkowy
Bazy
 Amoniak jest podstawową substancją
Amoniak jest podstawową substancją Charakterystyka podstawowa
Podstawy przedstawiają następujące cechy:
-Wytwarzają lepkie uczucie lub mydło w palcach, powodując, że obiekty są przyjęte przez ręce.
-Mają gorzki smak.
-Mogą reagować z kwasami, wytwarzając tworzenie się związków zwanych solami. W niektórych przypadkach mogą one wytrącić lub zatopić się w wodzie. Również w reakcji zasady z kwasem powstaje woda.
-Zmieniają kolor niebieskiego papieru kiełkowego, co wskazuje, że roztwór ma pH większy niż 7 lub alkaliczny.
-Niektóre zasady obecne w ich wzorze chemicznym OH, zwane hydroksylli, które są tworzone przez atom wodoru i atom tlenu.
Silny i słaby
Silne zasady to związki chemiczne, które przedstawiają jedną lub więcej grup OH w ich strukturze chemicznej, które po kontaktu z wodą nabierają ujemnego obciążenia, OH-.
Tymczasem słabe zasady nie występują w swoich grupach chemicznych hydroksylów. Jednak słabe podstawy podczas reagowania z wodą wytwarzają również jony lub aniony oh-.
Silne zasady, takie jak wodorotlenek sodu, mają bardzo wysokie wartości pH, blisko 14. Tymczasem słabe zasady mają niższe pH, takie jak amoniak, który ma pH 11.
Może ci służyć: gotowanie: koncepcja, typy i przykładySilne podstawy są używane w domach do odkrycia drenaż. Tak jest w przypadku wodorotlenku potasu. Tymczasem w pracach czyszczących używane są słabe podstawy, takie jak amoniak obecny w wielu środkach czyszczących.
Przykłady baz
Silne bazy
-Lioh: wodorotlenek litu
-NaOH: wodorotlenek sodu
-Koh: wodorotlenek potasu
-RBOH: wodorotlenek Rubidio
-CSOH: wodorotlenek cezu
-SR (OH)2: Wodorotlenek strontu
-BA (OH)2: wodorotlenek baru
Słabe bazy
-NH3: amoniak
-Nhet2: dietyloamina
-NH2Ch3: Metilamina
-C5H5N: pirydyna
Różnice między kwasami i zasadami
Jony, które wydają
Kwasy uwalniają atomy H+ lub h3ALBO+ Kiedy rozpuszczają się w wodzie. Tymczasem podstawy uwalniają lub produkują w kontakcie z jonami wodnymi OH-.
Wartości pH
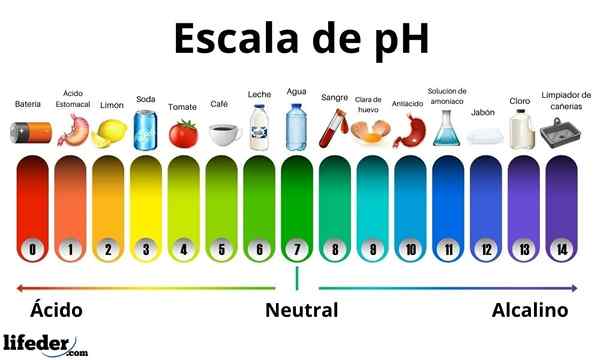
Kwasy mają wartość pH od 0 do 7. Tymczasem podstawy mają wartość pH między 7 a 14. Dlatego kwasy zmieniają kolor papieru kiełkowego, a podstawy obracają go na niebiesko.
Reakcje treningowe
Kwasy pochodzą z reakcji elementów niemetalicznych tlenków, na przykład chloru, siarki itp., Z wodą lub powstają również, gdy wodór jest połączony z elementem niemetalicznym, a następnie utworzonym związek rozpuszcza się w wodzie (HF, HCL, HBR itp.).
Zasady są wytwarzane przez reakcję tlenku metalu, na przykład żelazo, miedź, magnez itp., Z wodą. Należy pamiętać, że tlenek jest połączeniem atomów tlenu z dowolnym innym elementem chemicznym.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Definicja kwasu i przykład. Odzyskane z: Thoughtco.com
- Odkrywcy nauki. (31 lipca 2018 r.). Uczenie dzieci o kwasach i podstawach. Odzyskane od: Science Explorers.com
- Opracowanie przykładu. (2013). Charakterystyka kwasu. Odzyskane z: przykład.com
- Chemia lumen dla nie-majsterbów. (S.F.). Właściwości kwasów i podstaw. Odzyskane z: kursów.Lumenarning.com
- Clark Jim. (2013). Silne i słabe podstawy. Odzyskane z: chemguide.współ.Wielka Brytania
- « Flora i fauna gatunków reprezentatywnych Ekwadorii Sierra
- Ramy metodologiczne, jak to pisać, struktura, przykłady »

