Funkcje i cechy Centriolos
- 3828
- 567
- Prokul Woliński

Centriolos Są to cylindryczne struktury komórkowe złożone z grup mikrotubul. Są one tworzone przez białko tubuliny, które występuje w większości komórek eukariotycznych.
Powiązana para wirówek, otoczona masy gęstego materiału zwanego materiałem pericentryolarnym (PCM), składa strukturę o nazwie Center.
Funkcją centrioli polega na skierowaniu montażu mikrotubul, uczestniczących w organizacji komórkowej (położenie jądra i przestrzenne rozmieszczenie komórki), tworzenie i funkcjonowanie wici i rzęsek (cylogeneza) oraz podziału komórek (mitoza i mejoza).
Centriolos znajdują się w strukturach komórkowych znanych jako komórki zwierzęce i są nieobecne w komórkach roślinnych.
Wady w strukturze lub liczbie centrioli w każdej komórce mogą mieć znaczące konsekwencje dla fizjologii organizmu, powodując zmiany w odpowiedzi na stres podczas stanu zapalnego, niepłodność mężczyzn, choroby neurodegeneracyjne i tworzenie guza, między innymi.
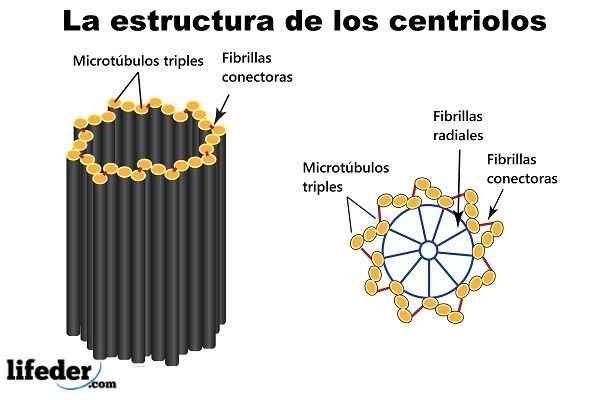
Centriole to struktura cylindryczna. Para powiązanych centrioli, otoczona masowym raportem o gęstym materiale (zwanym „materiałem pericentrycznym” lub PCM), tworzy strukturę złożoną zwaną „centrami”.
Uważali się za nieistotne jeszcze kilka lat temu, kiedy główne organelle zostały zakończone w prowadzeniu podziału komórek i powielania (mitozy) w komórkach eukariotycznych (głównie u ludzi i innych zwierząt).
Centriol
Dziewięć modernambulów ustawionych wokół obwodu (tworzącego krótki pusty cylinder), to „bloki konstrukcyjne” i główna struktura centrioli.
Przez wiele lat struktura i funkcja centrioli była ignorowana, chociaż w latach 80. XIX wieku centra wizualizowano za pomocą mikroskopii optycznej.
Theodor Boveri opublikował przełomowe dzieło w 1888 roku, opisując pochodzenie centrów z nasienia po zapłodnieniu. W swojej krótkiej komunikacji w 1887 r. Boveri napisał, że:
„Centrowanie reprezentuje dynamiczne centrum komórki; Jego podział tworzy centra utworzonych komórek potomnych, wokół których wszystkie inne składniki komórkowe są zorganizowane symetrycznie ... Centra są prawdziwym narządem komórek, on połowę podziału jądrowego i komórkowego ”(Scheer, 2014: 1). [Tłumaczenie autora].
Krótko po połowy wieku, wraz z rozwojem mikroskopii elektronicznej, zachowanie centrioli zostało zbadane i wyjaśnione przez Paula Schafer.
Niestety, praca ta została w dużej mierze zignorowana z powodu faktu, że zainteresowanie badaczy zaczęło koncentrować się na ustaleniach Watsona i Kricka na DNA.
Centrum

Para centrioli, znajdująca się w sąsiedztwie jądra i prostopadła do siebie, jest „centrowaniem”. Jeden z centrioli jest znany jako „ojciec” (lub matka). Drugi jest znany jako „syn” (lub córka; jest nieco krótszy i ma swoją podstawę do bazy matki).
Bliższe końce (w związku z dwoma centrioli) są zanurzone w „chmurze” białka (być może do 300 lub więcej) znanych jako Microtubules Organization Center (MTOC), ponieważ zapewnia niezbędne białko do budowy konstrukcji. Mikrotubule.
Może ci służyć: żywotność badańMTOC jest również znany jako „materiał pericentrenowy” i ma obciążenie ujemne. Odwrotnie, dystalne końce (z dala od połączenia dwóch centrioli) są dodatnio załadowane.
Para centrioli wraz z otaczającym MTOC jest znana jako „centrum”.
Duplikacja centrów
Kiedy centryle zaczynają się powielić, ojciec i syn rozdzielają się nieznacznie, a potem każda centriole zaczyna tworzyć nowe centriolo w swojej bazie: ojciec z nowym synem i syna z nowym synem („wnuk” („wnuk” ).
Podczas gdy występuje powielanie centrioli, rdzeń DNA jest również duplikat. Oznacza to, że obecne badania pokazują, że powielanie centrioli i oddzielenie DNA są w jakiś sposób powiązane.
Duplikacja i podział komórek (mitoza)

Proces mitotyczny jest często opisywany w kategoriach fazy inicjatywnej, znanej jako „interfejs”, a następnie cztery fazy rozwoju.
Podczas interfejsu Centriole podwójnie i podzielone na dwie pary (jeden z tych rówieśników zaczyna poruszać się w kierunku przeciwnej strony jądra), a DNA jest podzielony.
Po duplikacji centrioli mikrotubule centrioli rozciągają się i wyrównują wzdłuż głównej osi jądra, tworząc „wrzeciono mitotyczne”.
W pierwszej z czterech faz rozwoju (faza I lub „profas”) chromosomy kondensują i podejście, a błona jądrowa zaczyna osłabiać i rozpuszczać. Jednocześnie wrzeciona mitotyczne powstaje z parami centriolowymi znajdującymi się teraz na końcach wrzeciona.
W drugiej fazie (faza II lub „metafaza”) łańcuchy chromosomów są wyrównane z osą wrzeciona mitotycznego.
W trzeciej fazie (faza III lub „anafaza”) łańcuchy chromosomalne są podzielone i poruszają się w kierunku przeciwnych końców wrzeciona mitotycznego, obecnie wydłużone.
Wreszcie, w czwartej fazie (faza IV lub „telofaza”) powstają nowe błony jądrowe wokół oddzielnych chromosomów, wrzeciona mitotyczne jest cofnięte, a separacja komórek zaczyna się zakończyć za pomocą połowy cytoplazmy, która pasuje do każdego nowego jądra.
Na każdym końcu wrzeciona mitotycznego pary centrioli wywierają istotny wpływ (najwyraźniej związany z siłami wywieranymi przez pola elektromagnetyczne generowane przez ujemne i dodatnie obciążenia ich proksymalnych i dystalnych końców) w komórce podziału komórkowego podziału komórek.
Centra i odpowiedź immunologiczna
Ekspozycja na stres wpływa na funkcję, jakość i czas trwania życia organizmu. Wygenerowany stres, na przykład przez infekcję, może prowadzić do zapalenia zakażonych tkanek, aktywując odpowiedź immunologiczną w organizmie. Ta odpowiedź chroni dotknięte ciało, eliminując patogen.
Wiele aspektów funkcjonalności układu odpornościowego jest dobrze znanych. Jednak zdarzenia molekularne, strukturalne i fizjologiczne, w które zaangażowane są centra, są nadal zagadką.
Może ci służyć: raport eksperymentuOstatnie badania wykazały nieoczekiwane dynamiczne zmiany struktury, lokalizacji i funkcji centrów w różnych warunkach związanych ze stresem. Na przykład po naśladowaniu warunków infekcji stwierdzono wzrost produkcji PCM i mikrotubule w komórkach interfejsu.
Centra w synapsach odpornościowych
Centra odgrywają bardzo ważną rolę w strukturze i funkcji synaps immunologicznych (SI). Struktura ta powstaje przez wyspecjalizowane interakcje między komórką T a antygenem prezentującym komórkę (CPA). Ta interakcja komórkowa rozpoczyna migrację centrującego w kierunku SI i jej późniejszego sprzężenia z błoną plazmatyczną.
Centralne sprzężenie w SI jest podobne do obserwowanego podczas cylogenezy. Jednak w tym przypadku nie rozpoczyna się montażu rzęsek, ale uczestniczy w organizacji SI i wydzielaniu pęcherzyków cytotoksycznych w celu lizaru komórek docelowych, stając się kluczowym narządem w aktywacji komórek T.
Stres środkowy i cieplny
Centra są celem „chaperonas molecular” (zestaw białka, którego funkcją jest pomoc składania i transportu komórek innych białek), które zapewniają ochronę przed narażeniem na wstrząs termiczny i naprężenie.
Wśród czynników stresowych, które wpływają na ośrodki, uwzględniono uszkodzenie DNA i ciepła (takie jak ten cierpiący przez gorączkowe komórki pacjenta). Uszkodzenie DNA rozpoczyna szlaki naprawy DNA, które mogą wpływać na funkcję centrów i składu białka.
Stres generowany przez ciepło powoduje modyfikację struktury centrioli, zakłócenie centrów i całkowitą inaktywację jego zdolności do tworzenia mikrotubul, zmieniając tworzenie się wrzeciona mitotycznego i zapobiegając miitozie.
Przerwanie funkcji centrów podczas gorączki może być adaptacyjną reakcją na inaktywowanie biegunów wrzeciona i zapobieganie nieprawidłowym podzieleniu DNA podczas mitozy, szczególnie biorąc pod uwagę potencjalną dysfunkcję wielu białek po denaturacji indukowanej ciepłem.
Może również zapewnić komórkę do odzyskania funkcjonalnej puli białek przed ponownym uruchomieniem podziału komórek.
Inną konsekwencją inaktywacji centrowania podczas gorączki jest jego niezdolność do przejścia do jego zorganizowania i uczestnictwa w wydzielaniu pęcherzyków cytotoksycznych.
Nieprawidłowy rozwój centrioli
Rozwój centrolo jest procesem jest dość złożony i chociaż w nim uczestniczą seria białek regulacyjnych, mogą wystąpić różne rodzaje awarii.
Jeśli istnieje nierównowaga w proporcji białek, dziecko centrolo może być wadliwe, jego geometria może być zniekształcona, osie pary mogą odbiegać od prostopadłości, wiele dzieci może się rozwijać, syn centriole może osiągnąć pełną długość przed czasem, lub pary oddzielenia można opóźnić.
Może ci służyć: środowisko naturalne i społeczne w satysfakcji ludzkich potrzebGdy występuje niewłaściwe lub błędne powielanie centrioli (z wadami geometrycznymi i / lub wielokrotnym duplikacją), replikacja DNA jest zmieniana, przedstawiono niestabilność chromosomów (CIN).
Podobnie, centra ośrodków (na przykład powiększone lub rozszerzone centrowanie) prowadzą do CIN i promują rozwój wielu dzieci Centriole.
Te błędy rozwojowe generują uszkodzenie komórek, które mogą nawet prowadzić do złośliwego.
Nieprawidłowe centriole i złośliwe komórki
Dzięki interwencji białek regulacyjnych, gdy anomalie są wykrywane w rozwoju centrioli i/lub centrujących, komórki mogą wdrożyć samokontrocję anomalii.
Jeśli jednak samookreścijanie anomalii, nieprawidłowych centrioli lub z wieloma dziećmi („można osiągnąć supernumerarne centryle”) może prowadzić do wytwarzania guzów („nowotworu”) lub śmierci komórkowej śmierci komórkowej.
Supernumeralne centriole mają tendencję do spotykania się, co prowadzi do grupowania centrów („amplifikacja centrów”, charakterystyczna dla komórek rakowych), zmieniając polaryzację komórek i normalny rozwój mitozy, co powoduje pojawienie się guzów.
Komórki z nadprzyrodzonymi centrioleami charakteryzują się przedstawieniem nadmiaru materiału okołowoczerolarnego, przerwy cylindrycznej struktury lub nadmiernej długości nieodważących lub słabo umieszczonych centrioli i centrioli.
Sugerowano, że klastry centrioli lub centrów w komórkach rakowych mogą służyć jako „biomarker” w stosowaniu środków terapeutycznych i wyobraźni, takich jak nanocząstki superparamagnetyczne.
Bibliografia
- Borisy, g., Heald, r., Howard, J., Janke, c., Musacchio, a., & Nogales i. (2016). Mikrotubule: 50 lat od odkrycia tubuliny. Nature Reviews Molecular Cell Biology, 17 (5), 322-328.
- Buchwalter, r. DO., Chen, J. V., Zheng i., I MeGraw, T. L. Centra w podziale komórek, rozwoju i chorobie. Els.
- Gambarotto, zm., & Basto, r. (2016). Pojanie wady centrów numerycznych w rozwoju i chorobie. W cystoszkielecie mikrotubul (PP. 117-149). Springer Wiedeń.
- Huston, r. L. (2016). Przegląd aktywności centrioli i bezprawnej aktywności podczas podziału komórki. Advances in Bioscience and Biotechnology, 7 (03), 169.
- Inaba, k., I Mizuno, K. (2016). Dysfunkcja nasienia i ciliopatia. Medycyna i biologia reprodukcyjna, 15 (2), 77-94.
- Keeling, j., Tsiokas, l., & Maskey, D. (2016). Mechanizmy komórkowe kontroli długości rzęsek. Komórki, 5 (1), 6.
- Lodish, h., Berk, a., Kaiser, c. DO., Krieger, m., Bretscher, a., Ploegh, godz., Amon, a., Martin, k. C. (2016). Biologia komórek molekularnych. Nowy Jork: W. H. Freeman and Company.
- Matamoros, a. J., & Baas, p. W. (2016). Mikrotubule w zdrowiu i chorobie zwyrodnieniowej układu nerwowego. Biuletyn Brain Research, 126, 217-225.
- Pellegrini, L., Wetzel, a., Grannó, s., Heaton, g., & Harvey, k. (2016). Powrót do kanalików: Dynamika mikrotubul w chorobie Parkinsona. Nauk o życiu komórkowym i molekularnym, 1-26.
- Scheer, u. (2014). Historyczne korzenie centrów Research: Odkrycie slajdów mikroskopowych Boveri w Würzburgu. Phil. Trans. R. Soc. B, 369 (1650), 20130469.

